
Resorbierbarer Magnesium-Scaffold (RMS)
Bitte füllen Sie das untenstehende Formular aus und ein BIOTRONIK-Vertreter wird sich in Kürze mit Ihnen in Verbindung setzen. Danke schön.
Fordern Sie weitere Informationen an und ein BIOTRONIK-Vertreter wird sich gerne mit Ihnen in Verbindung setzen.
Kontaktieren Sie uns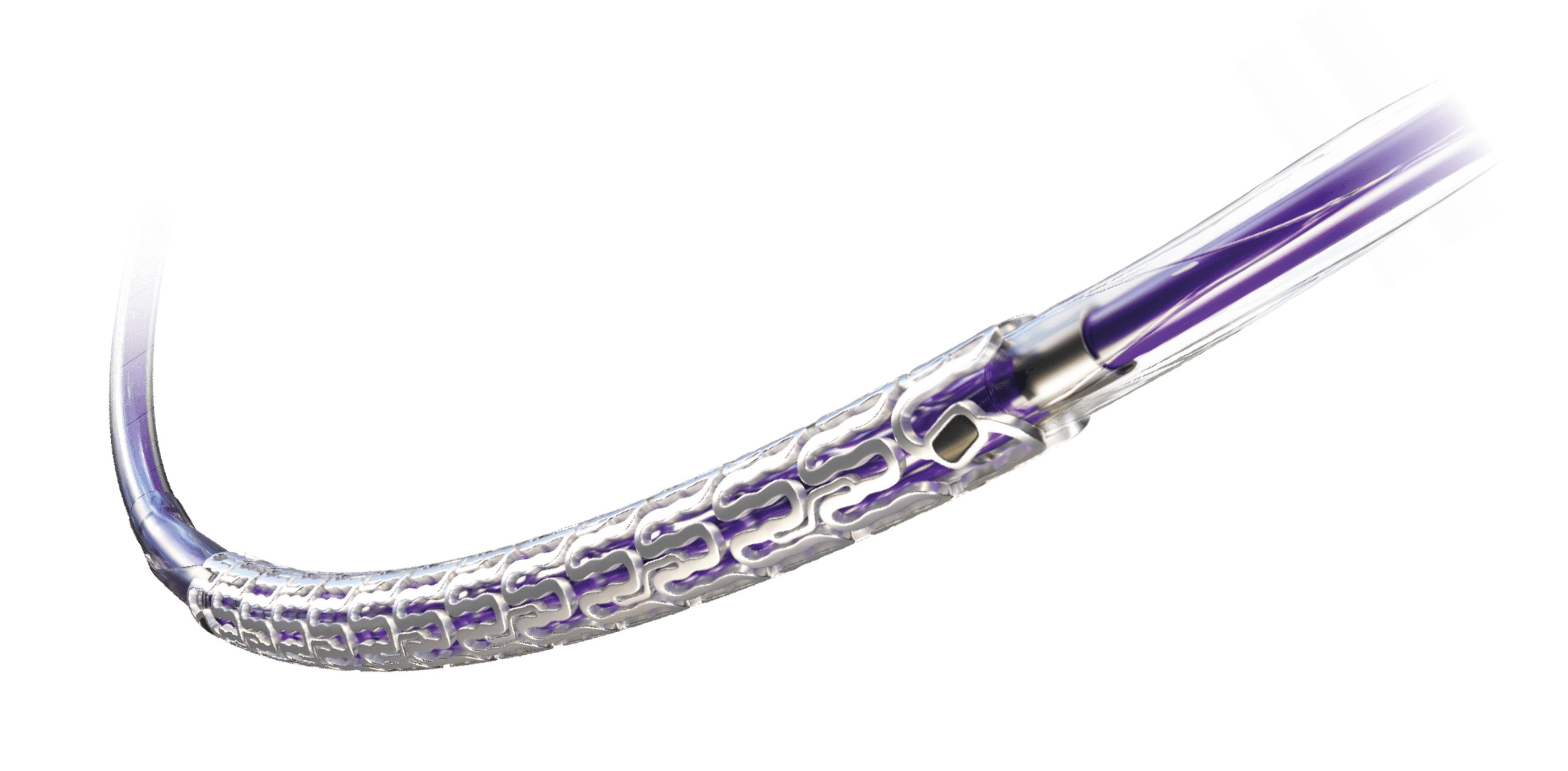





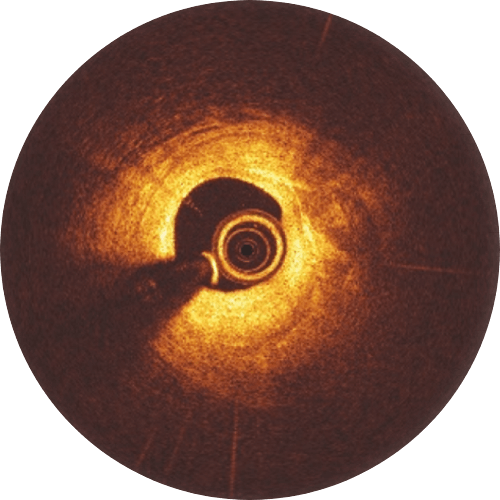
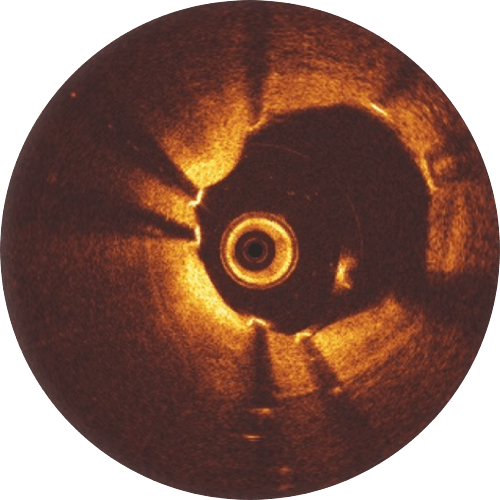
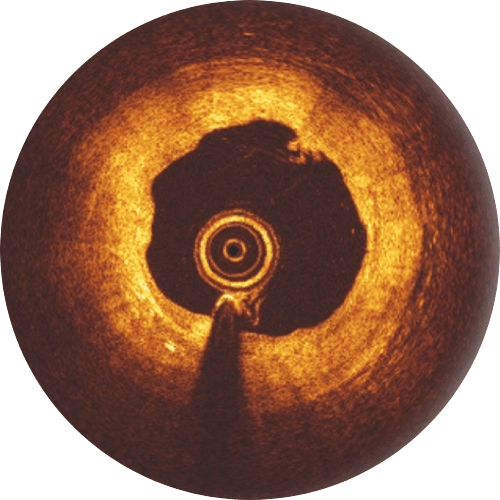
Erfahrungsgemäß werden bessere Patientenergebnisse erzielt, wenn bei der Implantation des Freesolve RMS das „4P“-Protokoll befolgt wird.
Die richtige Patientenauswahl ist ausschlaggebend für den Verfahrenserfolg. Freesolve ist derzeit für De-Novo-Läsionen mit einem Referenzgefäßdurchmesser und einer Läsionslänge zugelassen, die genau den verfügbaren Freesolve-Größen entsprechen. Jeder einzelne Patient sollte die beste klinische Versorgung erhalten und von der RMS-Technologie profitieren.
Wenn Sie hinsichtlich des Gefäßdurchmessers unsicher sind, QCA, IVUS und/oder OCT für die quantitative Läsionsbeurteilung anwenden. Da die verfügbaren Durchmesser 2,5 mm, 3,0 mm, 3,5 mm und 4,0 mm betragen, nicht in Gefäße mit einem Durchmesser > 4,2 mm implantieren. Im Angiogramm wird der Gefäßdurchmesser im Allgemeinen um 0,25 mm unterschätzt.
Eine Prädilatation mit einem non-compliant-Ballon mit einem Ballon-Arterien-Verhältnis von 1:1 ist obligatorisch. Der Ballon sollte vollständig aufgedehnt sein. Die Reststenose vor der Implantation des Freesolve sollte weniger als 20 % betragen. Wenn das Prädilatationsziel nicht erreicht wird, andere Ballontechnologien anwenden, wie zum Beispiel Scoring-Ballonkatheter.
Eine Postdilatation mit einem non-compliant-Ballon, der bis zu 0,5 mm größer als der implantierte Scaffold ist und bei hohem Druck (> 16 atm) expandiert wird, ist empfehlenswert. Bitte beachten Sie, dass die Expansionsgröße des Freesolve 0,6 mm über der normalen Scaffoldgröße liegt. Während der Lernphase ist es hilfreich, Gefäß- und Lumengröße, Läsionslänge sowie eine mögliche Malapposition der Streben mittels OCT zu überprüfen.
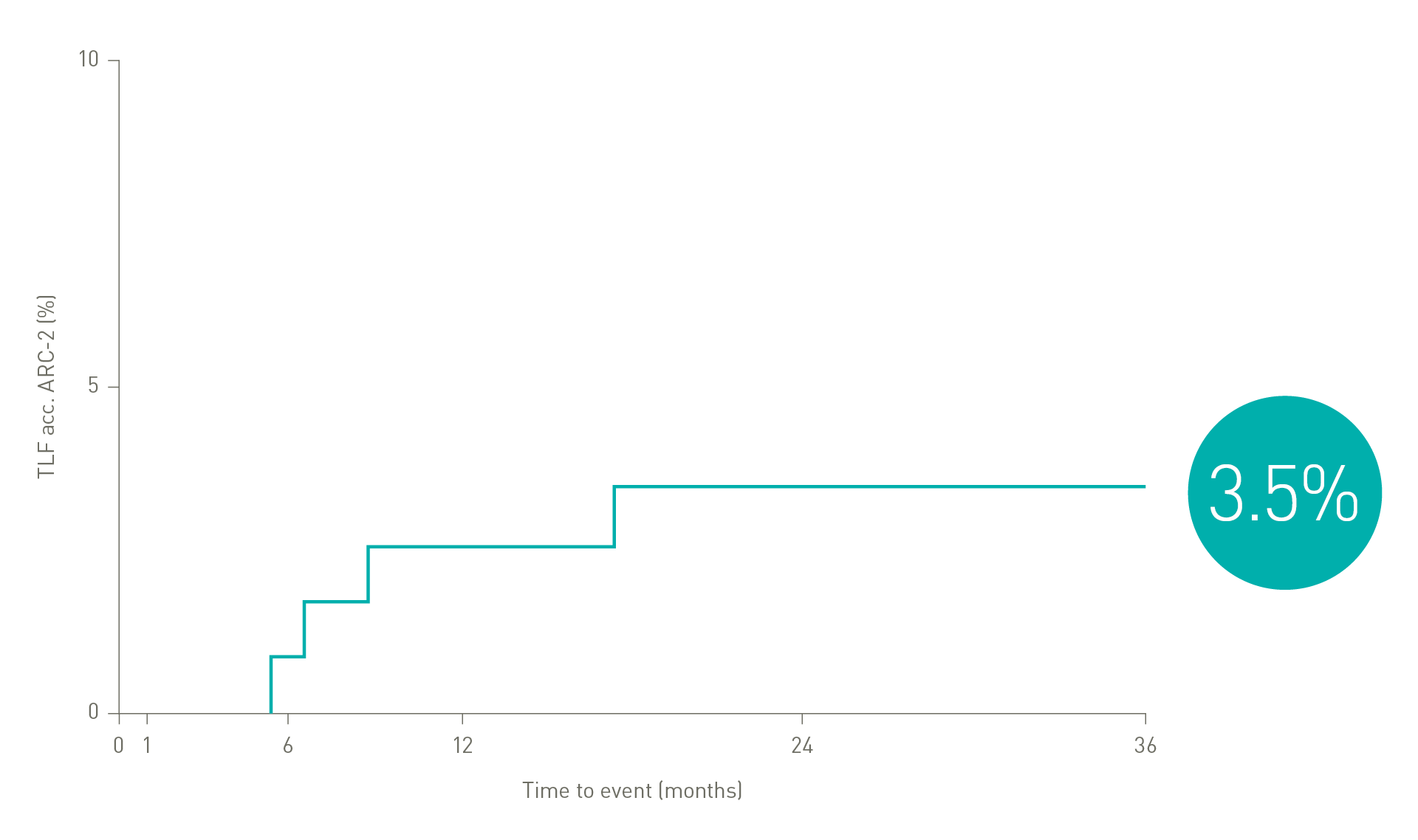
Eine Vielzahl klinischer Belege
*restricted access, sign-in required



Prof. Michael Haude (Rheinklinikum Neuss) spricht über Freesolve™, die Ergebnisse der First-in-Human-Studie BIOMAG-I und ihre Auswirkungen auf die Zukunft der Scaffolds.
Prof. Michael Joner (Deutsches Herzzentrum München) erklärt den Resorptionsprozess von Freesolve™, dem RMS der neuen Generation, und wie der Scaffold trotz dünnerer Streben und einer Resorptionszeit von 12 Monaten eine längere Gefäßunterstützung ermöglicht.
Dr. Masaru Seguchi (Deutsches Herzzentrum München) berichtet über Ziel und Ergebnisse der BIOMAG-I-OCT-Analyse und erläutert, was die Daten für die Zukunft der Kardiologie bedeuten.