Vaskuläre Intervention // Koronar
Resorbierbarer Magnesium-Scaffold (RMS)
Magmaris®

 Überzeugende Sicherheitsdaten
Überzeugende Sicherheitsdaten
 Kurze Resorptionszeit
Kurze Resorptionszeit
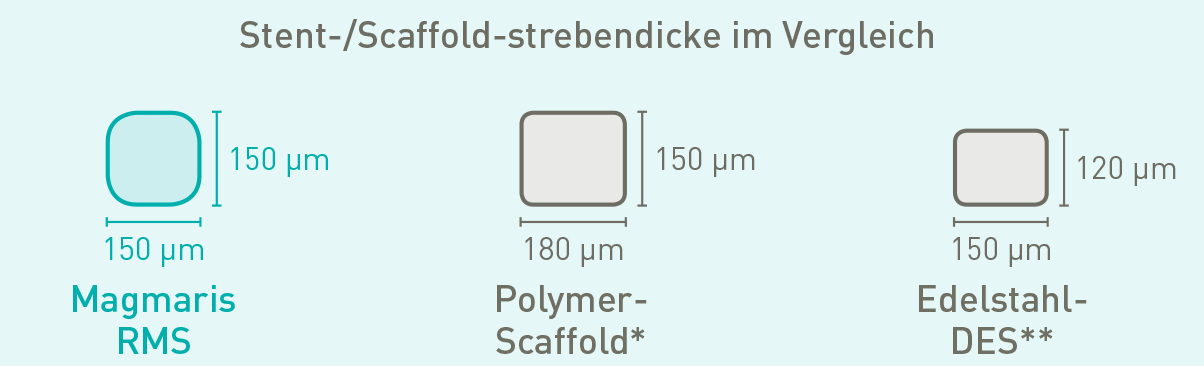
 Ein besser platzierbarer Scaffold
Ein besser platzierbarer Scaffold

Warum Magnesium?
Magnesiumlegierung: günstige mechanische Eigenschaften einer robusten Magnesiumbasis
Robuste Magnesiumbasis
Die mechanische Festigkeit von Magnesium ist Polymeren wie PLLA überlegen.1

Stabile Rückstellkräfte (Recoil)
Magmaris weist nach 1 Stunde 38 % weniger Recoil auf.2
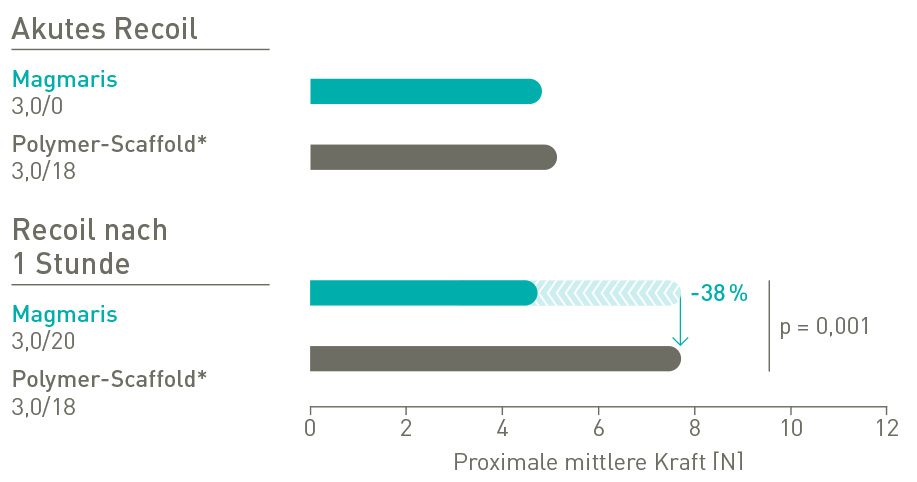
*Absorb, Abbott
Hoher radialer Widerstand
Bei zunehmendem physiologischem Druck erfolgt keine signifikante Veränderung des Durchmessers.3

Abgerundete Kanten und eine glatte Oberfläche
Die elektropolierten abgerundeten Kanten und die glatte Oberfläche des Magmaris-Scaffolds sorgen für weniger Widerstand bei der Scaffoldeinführung in die Läsion.


Überzeugende Sicherheitsdaten
Nachweisliche Sicherheit
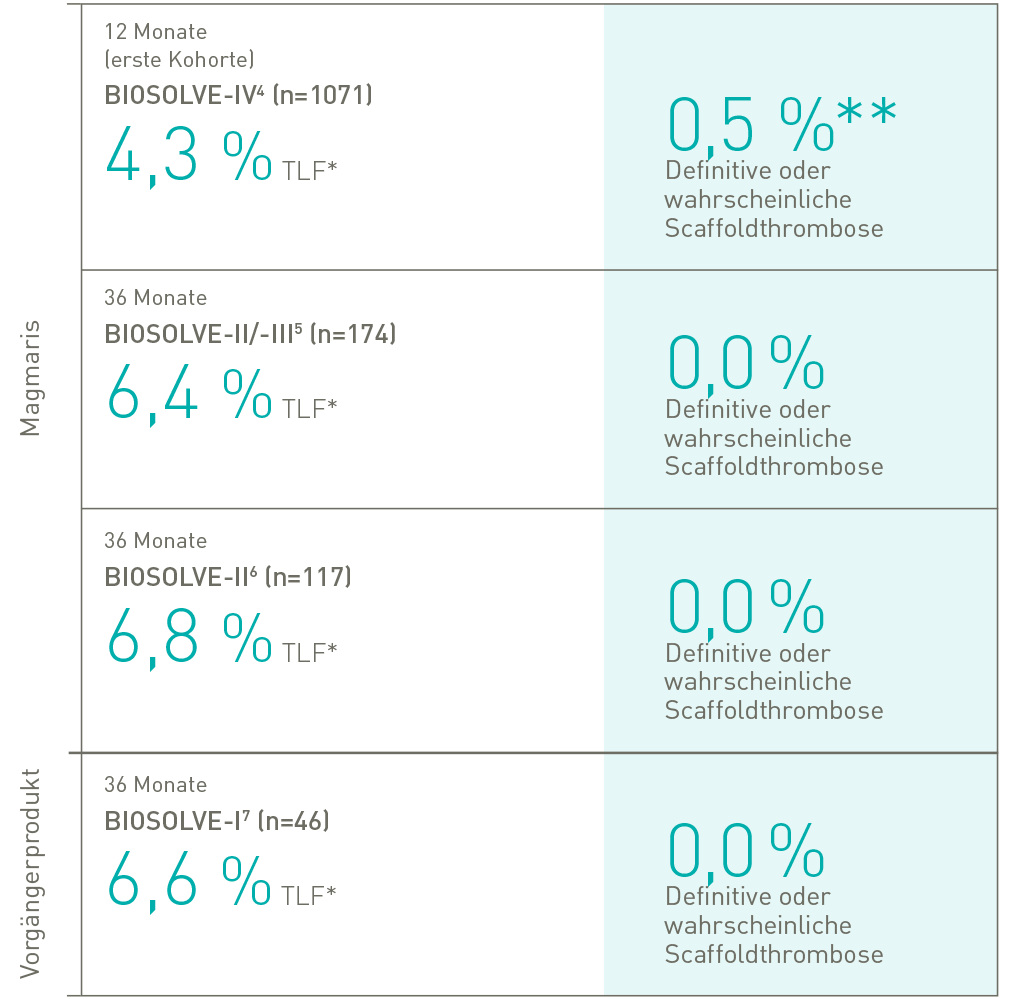
*Ziellasionsversagen: Zusammensetzung aus Herztod, Zielgefäß-Myokardinfarkt, klinisch bedingter Revaskularisierung der Zielläsion und CABG.
** Vier von fünf Fällen mit vorzeitiger Unterbrechung der DAPT oder der Antikoagulationstherapie nach dem Eingriff.

Kurze Resorptionszeit
~95 % des Magnesiums sind nach 12 Monaten resorbiert8

Ein besser platzierbarer Scaffold
Mehr als 70 % der Ärzte, die den Magmaris RMS in der klinischen Praxis verwendet haben, stuften diesen Scaffold besser als einen Polymer-Scaffold ein.10*

Bessere Läsionspassage
Bis zu 40 % geringere/r Läsionseintritt und Passierfähigkeit11
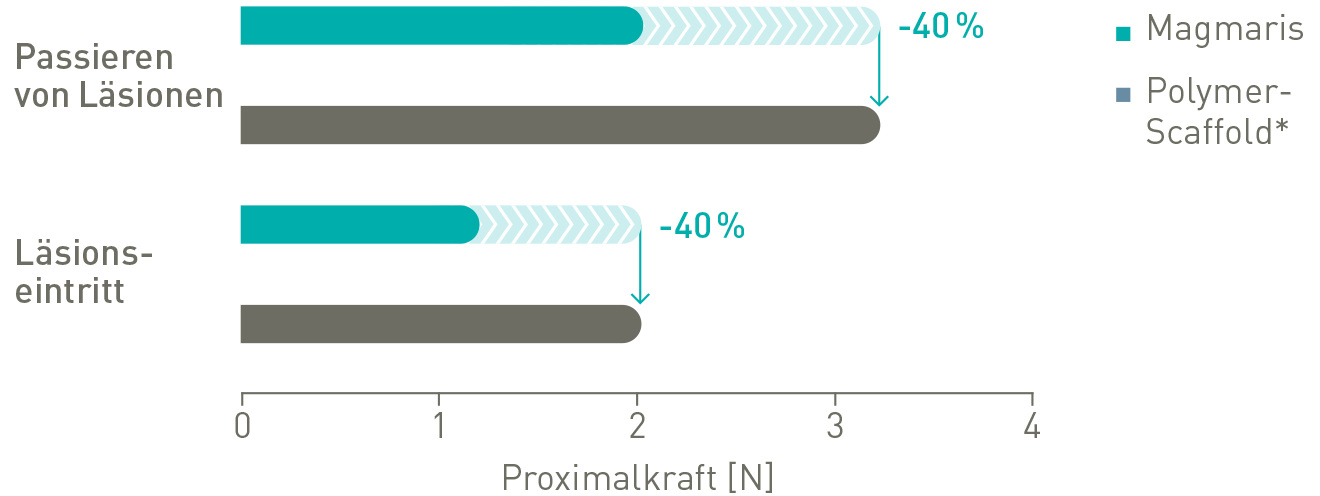
Bessere Gängigkeit in gewundener Anatomie
42 % weniger Spitzenbelastung12
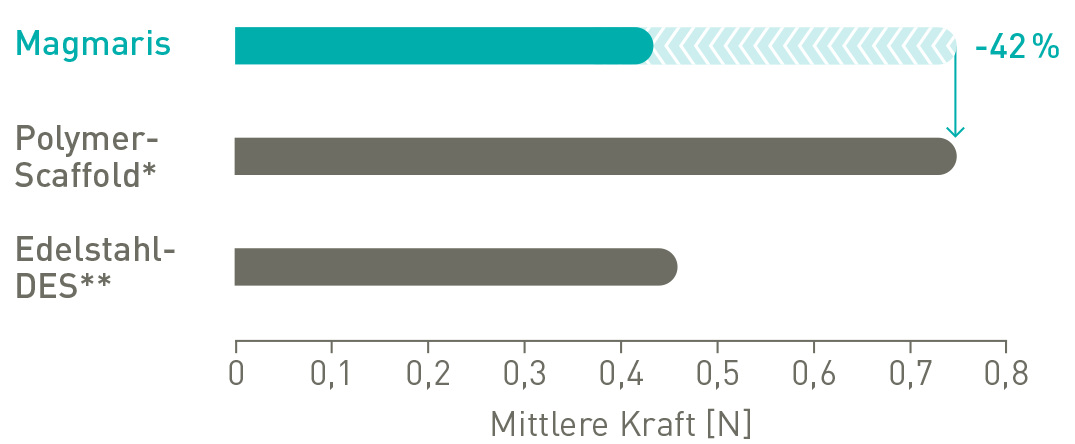
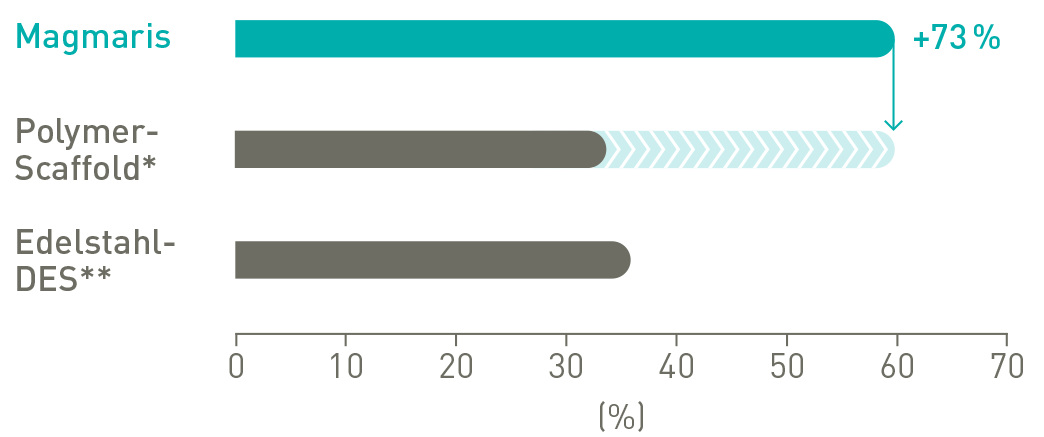
Bessere Vorschubfähigkeit
73 % mehr Übertragungskraft vom Hub bis zur Spitze13
* Absorb, Abbott
** BioFreedom, Biosensors
 Magmaris
Magmaris
Indiziert für die Behandlung von De-Novo-Läsionen der Koronararterien*
1-3, 10-13. BIOTRONIK Daten im Archiv. 4. Verheye S. Safety and Performance of the Resorbable Magnesium Scaffold, Magmaris in a Real World Setting - First Cohort Subjects at 12-month Follow-up of the BIOSOLVE-IV Registry. Präsentiert auf: TCT; 25.09.2019 San Francisco, USA. NCT02817802; (n = 2054; 1075 Patienten vorgestellt). 5. Haude M. Safety and Clinical Performance of the Drug Eluting Absorbable Metal Scaffold in the Treatment of Subjects with de Novo Lesions in Native Coronary Arteries at 36-month Follow-up-BIOSOLVE-II and -III, präsentiert auf: TCT; 27.09.2019; San Francisco, USA. 6. Haude M, Ince H, Abizaid A. Long-term clinical data and multimodality imaging analysis of the BIOSOLVE-II study with the drug-eluting absorbable metal scaffold in the treatment of subjects with de novo lesions in native coronary arteries - BIOSOLVE-II. Präsentiert auf: EuroPCR; 23.05.2018; Paris, Frankreich. 7. Haude M, Erbel R, Erne P, et al. Safety and performance of the Drug-Eluting Absorbable Metal Scaffold (DREAMS) in patients with de novo coronary lesions: 3-year results of the prospective, multicenter, first-in-man BIOSOLVE-I trial. EuroIntervention. 2016; 12: e160-e166. 8. Joner M, Ruppelt P, Zumstein P, et al. Preclinical Evaluation of Degradation Kinetics and Elemental Mapping of First and Second Generation Bioresorbable Magnesium Scaffolds. EuroIntervention. 2018 Feb 20. pii: EIJ-D-17-00708. doi: 10.4244/EIJ-D-17-00708. [Elektronische Veröffentlichung vor Druckversion]. 9. BIOSOLVE-II-Fall, GER443-012. Mit Genehmigung von M. Haude, Lukaskrankenhaus Neuss, Deutschland 2015.
Magmaris und BIOlute sind Marken oder eingetragene Marken der Unternehmensgruppe BIOTRONIK. Absorb ist eine Marke oder eingetragene Marke der Unternehmensgruppe Abbott. BioFreedom ist eine Marke oder eingetragene Marke der Biosensors International Group, Ltd.
*Indikation gemäß Gebrauchsanweisung
Technische Daten
| Scaffold | |
|---|---|
| Scaffoldmaterial | Unternehmenseigene Magnesiumlegierung |
| Marker | Zwei Tantalmarker an jedem Ende |
| Aktive Beschichtung | BIOlute (bioresorbierbares Poly-L-Lactid (PLLA), das einen Limus-Wirkstoff freisetzt) |
| Wirkstoffkonzentration | 1,4 μg/mm2 |
| Strebendicke/-breite | 150 μm/150 μm |
| Maximal expandierter Durchmesser | Nenndurchmesser +0,6 mm |
| Einführsystem | |
|---|---|
| Kathetertyp | Rapid exchange |
| Empfohlener Führungskatheter | 6F (min. I.D. 0,070") |
| Crossing-Profil | 1,5 mm |
| Führungsdraht-Durchmesser | 0,014" |
| Katheter-Arbeitslänge | 140 cm |
| Ballonmaterial | Semikristallines Polymer |
| Beschichtung (distaler Schaft) | Doppelbeschichtung |
| Ballonmarker | Zwei eingebettete Platin-Iridium-Marker |
| Proximaler Schaftdurchmesser | 2,0F |
| Distaler Schaftdurchmesser | 2,9F |
| Nominaldruck (NP) | 10 atm |
| Berstdruck (RBP) | 16 atm |
Compliance Tabelle
| Ballondurchmesser (mm) | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ø 3,00 | ø 3,50 | ||||||||||||||||||
| Nominaldruck | atm8 | 10 | 10 | ||||||||||||||||
| (NP) | ø (mm) | 3,00 | 3,54 | ||||||||||||||||
| Berstdruck | atm8 | 16 | 16 | ||||||||||||||||
| (RBP) | ø (mm) | 3,29 | 3,82 | ||||||||||||||||
Bestellinformationen
| Scaffold- ø (mm) | Scaffoldlänge (mm) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 15 | 20 | 25 | ||||||||||||
| 3,00 | 412526 | 412527 | 412528 | |||||||||||
| 3,50 | 412529 | 412530 | 412531 | |||||||||||

