Medikamentbeschichteter Ballonkatheter/0,018“/OTW
Passeo®-18 Lux®



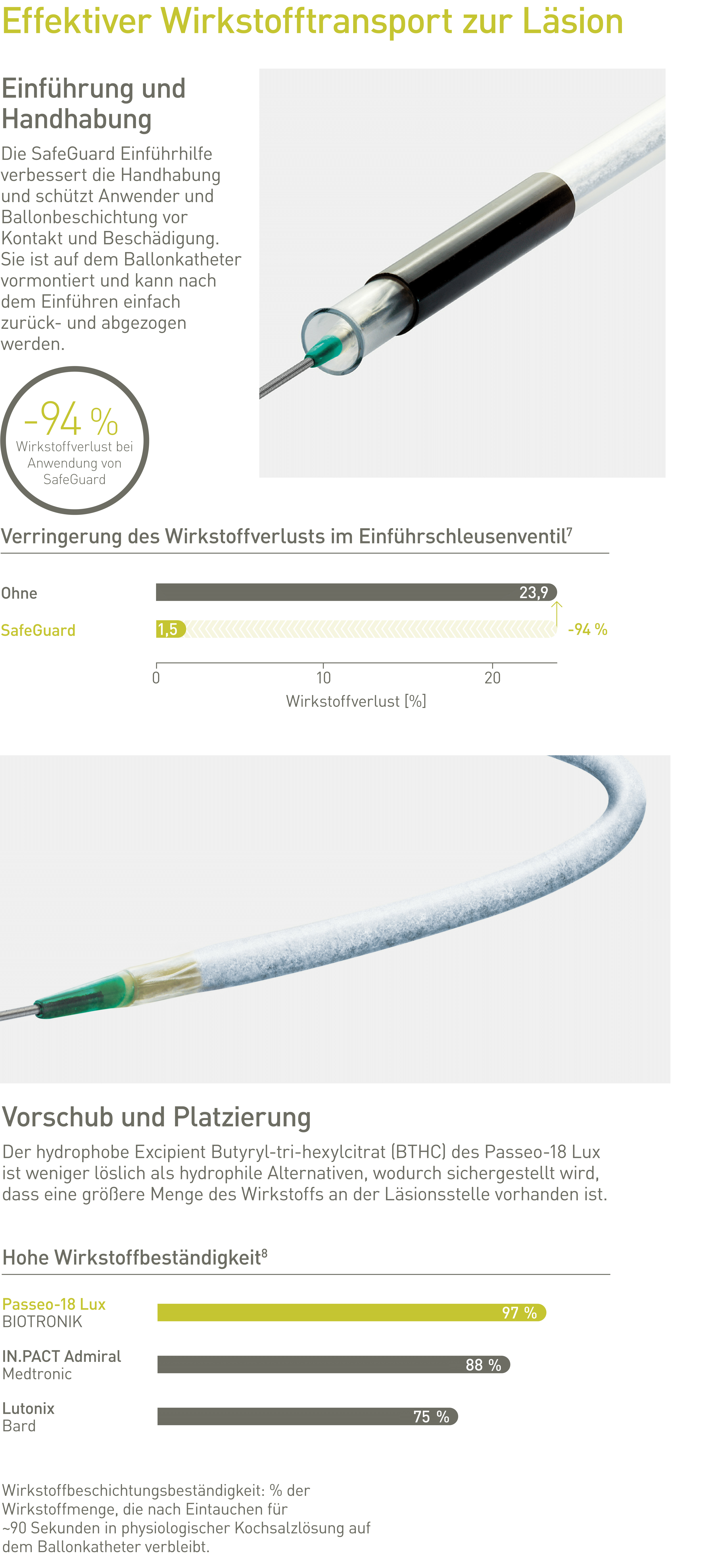

Indiziert für die Dilatation von De-Novo-Läsionen oder restenotischen Läsionen in infrainguinalen Arterien.*
1. Femoropopliteal lesions using a BTHC excipient: 12-month results from the BIOLUX P-I randomized trial. JEVT. 2015; 22(1): 14–21. 2. Zeller et al. Paclitaxel-Coated Balloon in Infrapopliteal arteries 12-month results from the BIOLUX P-II randomized trial. J Am Coll Cardiol Intv. 2015; 8: 1614–22. 3. Tepe G. BIOLUX P-III Ergebnisse nach 12 Monaten, SFASubgruppenanalyse. Präsentiert auf CIRSE 2017. 4. Schroe H. Stellarex drug-coated balloon for treatment of femoropopliteal arterial disease - The ILLUMENATE Global Study: 12-month results from a prospective, multicenter, single-arm study. Catheter Cardiovasc Interv. 2017; 1–8. 5. Thieme M. The 24-month Results of the Lutonix global SFA registry worldwide experience with Lutonix Drug-Coated Balloon. JACC. Cardiovascular Interventions. 2017:10:16:1691–1693. 6. IN.PACT Global, vollständige klinische Kohorte. Präsentiert von M. R. Jaff auf VIVA 2016. 7, 8, 9. BIOTRONIK Daten im Archiv.*Indikation gemäß Gebrauchsanweisung. Stellarex ist eine eingetragene Handelsmarke von Spectranetics; Lutonix ist eine eingetragene Handelsmarke von C. R. Bard; IN.PACT und Admiral sind eingetragene Handelsmarken von Invatec. Passeo ist eine Marke oder eingetragene Marke der Unternehmensgruppe BIOTRONIK. The Passeo®-18 Lux® DCB with its Lux® coating is part of the Lux® family of Paclitaxel-coated balloons from BIOTRONIK.
Technische Daten
| Passeo-18 Lux | |
|---|---|
| Kathetertyp |
OTW |
| Empfohlener Führungsdraht |
0,018" |
| Spitze |
Kurz, konisch |
| Ballonmarker |
2 eingesenkte Marker (Nullprofil) |
| Schaft |
3,8 F, hydrophobe Beschichtung |
| Arbeitslänge |
90, 130 cm; 150 cm (nur ø 2,0 mm) |
| Größe der Einführschleuse |
4 F (ø 2,0–4,0 mm); 5F (ø 5,0–7,0 mm) |
| Nominaldruck (NP) |
6 atm |
| Berstdruck (RBP) |
15 atm (ø 2,0–5,0 mm); 12 atm (ø 6,0–7,0 mm) |
| Wirkstoff |
Paclitaxel |
| Wirkstoffdosis |
3,0 μg/mm2 |
| Trägermatrix | Paclitaxel und Butyryl-tri-hexyl citrate (BTHC) |
| Beschichteter Bereich |
Zylindrischer Abschnitt des Ballons, über die proximalen und distalen Ballonmarker hinaus |
Compliance - Tabelle
| Ballondurchmesser x Länge (mm) | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nominaldruck | atm8 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | |||||||||||
| (NP) | ø (mm) | 2,0 | 2,5 | 3,0 | 4,0 | 5,0 | 6,0 | 7,0 | |||||||||||
| Berstdruck | atm8 | 15 | 15 | 15 | 15 | 15 | 12 | 12 | |||||||||||
| (RBP) | ø (mm) | 2,1 | 2,6 | 3,3 | 4,3 | 5,2 | 6,3 | 7,2 | |||||||||||
Bestellinformationen
| Ballon Länge (cm) | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Katheter Länge (cm) | Ballon ø (mm) | 40 | 80 | 120 | ||||||||||
| 90 | 2,0 (4F) | 379860 | 379861 | 379862 | ||||||||||
| 90 | 2,5 (4F) | 379866 | 379867 | 379868 | ||||||||||
| 90 | 3,0 (4F) | 370843 | 370848 | 370853 | ||||||||||
| 90 | 4,0 (4F) | 370844 | 370849 | 370854 | ||||||||||
| 90 | 5,0 (5F) | 370845 | 370850 | 370855 | ||||||||||
| 90 | 6,0 (5F) | 370846 | 370851 | 370856 | ||||||||||
| 90 | 7,0 (5F) | 370847 | 370852 | 370857 | ||||||||||
| 150 | 2,0 (4F) | 379863 | 379864 | 379865 | ||||||||||
| 130 | 2,5 (4F) | 379869 | 379870 | 379871 | ||||||||||
| 130 | 3,0 (4F) | 370858 | 370863 | 370868 | ||||||||||
| 130 | 4,0 (4F) | 370859 | 370864 | 370869 | ||||||||||
| 130 | 5,0 (5F) | 370860 | 370865 | 370870 | ||||||||||
| 130 | 6,0 (5F) | 370861 | 370866 | 370871 | ||||||||||
| 130 | 7,0 (5F) | 370862 | 370867 | 370872 | ||||||||||




