Orsiro® Mission
Der medikamentfreisetzende Stent Orsiro Mission ist indiziert für die Vergrößerung des Lumendurchmessers von Koronargefäßen bei Patienten mit symptomatischer ischämischer Herzerkrankung aufgrund stenotischer De-Novo-Läsionen und In-Stent-Restenosen (Länge ≤ 40 mm) in nativen Koronararterien mit einem Referenzgefäßdurchmesser von 2,25 mm bis 4,0 mm in folgenden Patienten- und Läsions-Untergruppen:
- Akutes Koronarsyndrom (ACS)
- Myokardinfarkt mit ST-Streckenhebung (STEMI)
- Diabetes mellitus (DM)
- Komplexe Läsionen (B2/C)
- Hohes Blutungsrisiko (HBR)
- Lange Läsionen (LL) (z. B. ≥ 20 mm)
- Kleine Gefäße (SV) (z. B. ≤ 2,75 mm)
- Multiple Gefäßerkrankung (MVD)
- Männlich/Weiblich
- Ältere Patienten (z. B. > 65 Jahre)
Produkt-Highlights
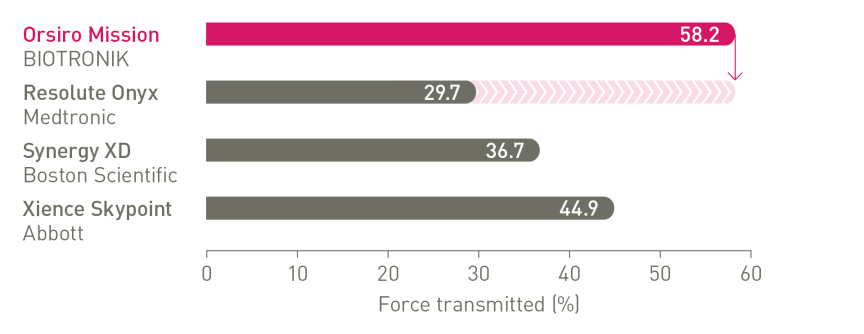
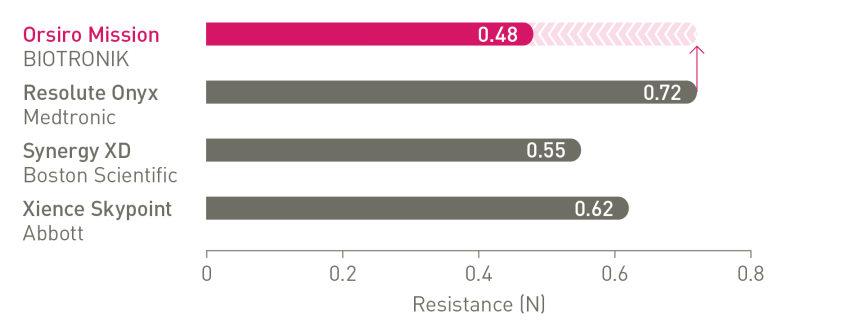
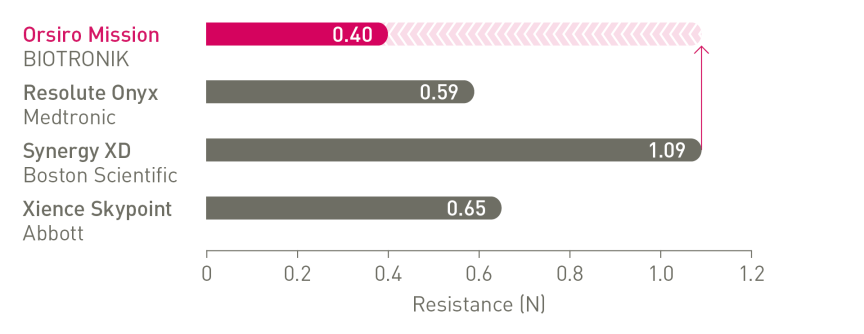
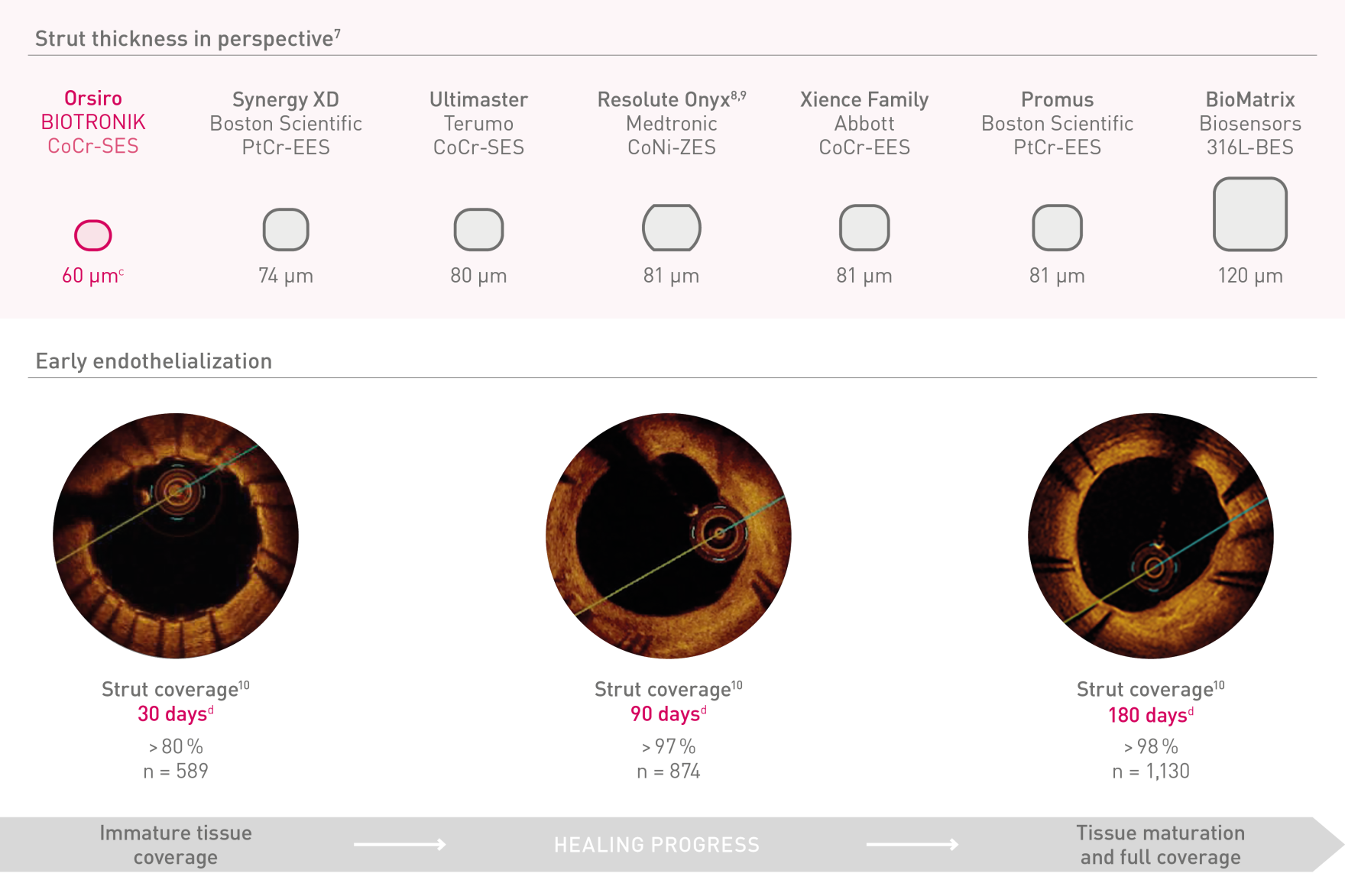
Neuer Standard für Platzierbarkeit¹
Marktführer bei Vorschub, Gängigkeit und Passage4
Ultradünne Streben²
Frühe Endothelialisierung5
Herausragende Patientenergebnisse³
Nachgewiesene Überlegenheit bei STEMI6
Anhaltende Überlegenheit bei STEMI nach 2 Jahrenf6
In der BIOSTEMI-Studie ist Orsiro dem Wettbewerbsprodukt Xience bei STEMI-Patienten überlegen in Bezug auf den primären Endpunkt Zielläsionsversagen (TLF) nach 24 Monaten.
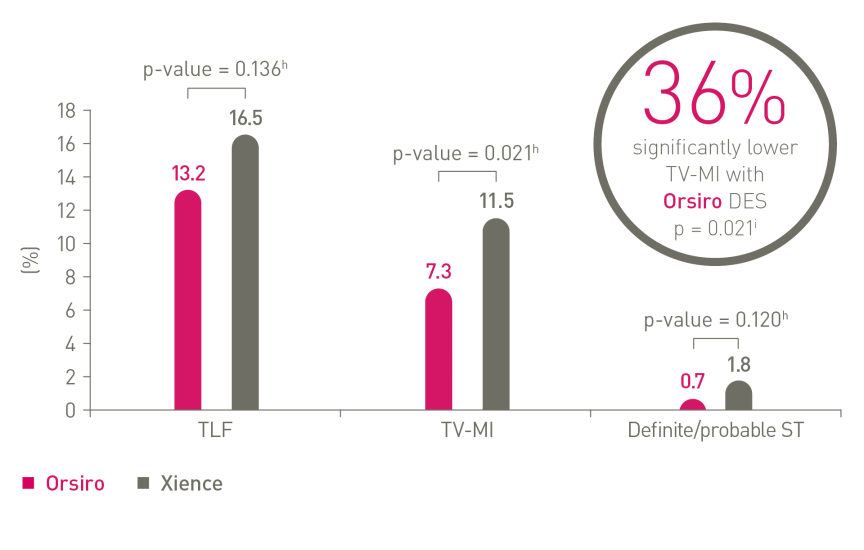
Neuer Maßstab für Sicherheit und Leistung mit Orsirog
Bei den 5-Jahres-Ergebnissen der FDA-Pivotstudie BIOFLOW-V zeigte der Orsiro DES mit ultradünnen Streben im Vergleich zum Xience DP-EES signifikant weniger Zielgefäß-Myokardinfarkte.12
Umfangreiches klinisches Studienprogramm zur Orsiro-DES-Familiej13
Produktüberblick
Orsiro Mission
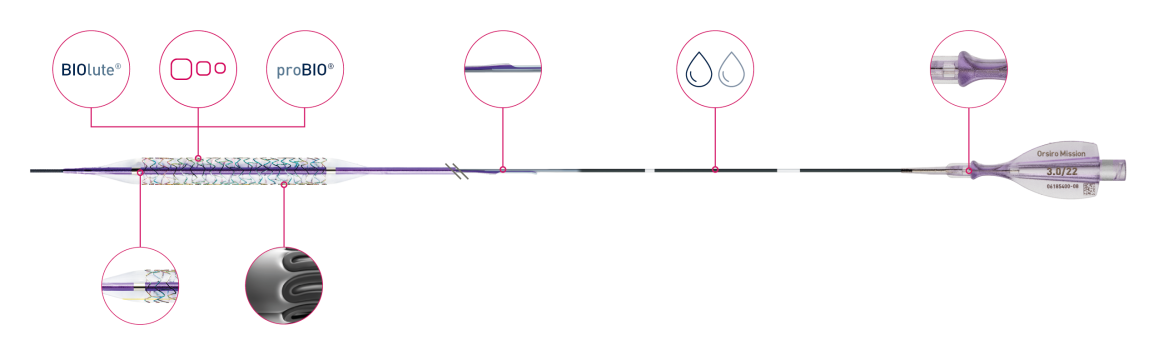
Bioabsorbierbare Beschichtung
Ultradünne 60-μmᶜ-Streben
Passive Beschichtung
Verbesserte Kraftübertragung
Doppelt beschichteter Schaft
Ergonomischer Hub
Flexibler Schaft
Tiefe Einbettung
Technische Daten
| Stent | |
|---|---|
| Stentmaterial | Kobalt-Chrom, L-605 |
| Strebendicke | ø 2,25 – 3,0 mm: 60 µm (0,0024”); ø 3,50 – 4,0 mm: 80 µm (0,0031") |
| Passive Beschichtung | proBIO® (amorphes Siliziumkarbid) |
| Aktive Beschichtung | BIOlute®, bioresorbierbares Poly-L-Lactid (PLLA), das einen Limus-Wirkstoff freisetzt |
| Wirkstoffkonzentration | 1,4 µg/mm² |
| Einführsystem | |
| Kathetertyp | Rapid-Exchange |
| Empfohlener Führungskatheter | 5 F (min. ID: 0,056") |
| Führungsdraht-Durchmesser | 0,014” |
| Katheter-Arbeitslänge | 140 cm |
| Ballonmaterial | Semikristallines Polymermaterial |
| Beschichtung (distaler Schaft) | Hydrophil |
| Beschichtung (proximaler Schaft) | Hydrophob |
| Markierungsbänder | Zwei eingebettete Platin-Iridium-Marker |
| Läsionseintrittsprofil | 0,017” |
| Distaler Schaftdurchmesser | 2,7 F: ø 2,25 – 3,0 mm; 2,9 F: ø 3,5 – 4,0 mm |
| Proximaler Schaftdurchmesser | 2,0 F |
| Nominaldruck (NP) | 10 atm |
| Berstdruck (RBP) | 16 atm |
| Lagerung | |
|---|---|
| Haltbarkeitsdatum (MHD) | 24 Monate |
| Temperatur | Zwischen 15 °C und 25 °C, kurzfristige Abweichungen zwischen 10 °C und 40 °C sind zulässig |
| Double Helix Stent Design | ||||||
|---|---|---|---|---|---|---|
| Nominal diameter (mm) | 2.25 | 2.5 | 2.75 | 3.0 | 3.5 | 4.0 |
| Strut thickness (μm) | 60 | = | = | = | 80 | = |
| Strut width (μm) | 75 | = | = | = | 85 | = |
| Amount of connectors | 3 | = | = | = | = | = |
| Amount of crowns at end | 8 | = | = | = | = | = |
| Maximal Expansion and Stent Strut Opening | ||||||
|---|---|---|---|---|---|---|
| Nominal diameter (mm) | 2.25 | 2.5 | 2.75 | 3.0 | 3.5 | 4.0 |
| Nominal outer diameter of the stent at NP (mm) | 2.37 | 2.62 | 2.87 | 3.12 | 3.66 | 4.16 |
| Maximal expansion diameter (mm) | 4.0 | = | = | = | 5.0 | = |
| Stent strut opening diameter at NP* (mm) | 0.79 | 0.92 | = | = | 1.06 | 1.25 |
| Maximal diameter of expanded stent cell (mm) | 3.59 | = | = | = | 4.42 | = |
*Mean of the largest possible opening diameter within a stent cell at NP
= symbol used to show repetition
Bestellinformationen
| Stent- ø (mm) |
Stentlänge (mm) |
||||||||
|---|---|---|---|---|---|---|---|---|---|
| 9 | 13 | 15 | 18 | 22 | 26 | 30 | 35 | 40 | |
| 2,25 | 419101 | 419107 | 419113 | 419119 | 419125 | 419131 | 419137 | 419143 | 419149 |
| 2,5 | 419102 | 419108 | 419114 | 419120 | 419126 | 419132 | 419138 | 419144 | 419150 |
| 2,75 | 419103 | 419109 | 419115 | 419121 | 419127 | 419133 | 419139 | 419145 | 419151 |
| 3,0 | 419104 | 419110 | 419116 | 419122 | 419128 | 419134 | 419140 | 419146 | 419152 |
| 3,5 | 419105 | 419111 | 419117 | 419123 | 419129 | 419135 | 419141 | 419147 | 419153 |
| 4,0 | 419106 | 419112 | 419118 | 419124 | 419130 | 419136 | 419142 | 419148 | 419154 |
Downloads und weitere Links
Downloads
Weitere Links
Medien
Produktanimationen
Wie können wir Ihnen helfen?
Referenzen
a. Im Vergleich zu Resolute Onyx; BIOTRONIK Daten im Archiv. b. Im Vergleich zu Synergy XD; BIOTRONIK Daten im Archiv. c. Ø 2,25-3,0 mm. d. Bilder: Secco G et al. Time-related changes in neointimal tissue coverage following a new generation SES implantation: an OCT observational study. Präsentiert auf: euro PCR, 20. Mai 2014; Paris, Frankreich. e. Bayessches Kredibilitätsintervall. f. Im Vergleich zu Xience, auf Basis der TLF in der BIOSTEMI-Studie nach 2 Jahren. g. Im Vergleich zu Xience, auf Basis statistisch signifikant geringerer Raten von TV-MI und später/sehr später definitiver/wahrscheinlicher ST gemäß BIOFLOW-V-Studie nach 5 Jahren. h. p-Werte für frequentistische 60-Monatsanalyse. i Im Vergleich zu Xience, auf Basis der 5-Jahres-Ergebnisse der BIOFLOW-V-Studie. j. Orsiro und Orsiro Mission DES. k. All-comers-Patienten, 5-Jahres-Ergebnisse der BIO-RESORT-Studie. l. Auf Basis des TLF-SUCRA-Score (Surface Under the Cumulative Ranking Curve) nach 1 Jahr, Netzwerk-Metaanalyse von Taglieri. m. Im Vergleich zu Xience, auf Basis eines Risikoverhältnisses von 0,58 in der BIOSTEMI-Studie nach 2 Jahren.
1. Im Vergleich zu Xience Sierra, Resolute Onyx und Synergy bei Bench-Tests zu Vorschubfähigkeit, Führbarkeit und Passierfähigkeit, BIOTRONIK Daten im Archiv. 2. Charakterisiert im Hinblick auf die Strebendicke in der Metaanalyse von Bangalore et al. 3. Auf Basis der Interpretation der primären Endpunktergebnisse durch den Prüfarzt bei der BIOFLOW-V-Studie. 4. BIOTRONIK Daten im Archiv. 5. Auf Basis der Interpretation durch die Prüfärzte in Secco et al. Imaging data serial observations. Secco GG et al. Time-related changes in neointimal tissue coverage of a novel Sirolimus eluting stent: Serial observations with optical coherence tomography. Cardiovascular Revascularization Medicine. 2016; 17(1): 38-43. 6. Pilgrim et al. Biodegradable – versus durable-polymer drug-eluting stents for STEMI. Final 2-year outcomes of the BIOSTEMI trial. J Am Coll Cardiol. Cardiovasc Interven. 2021, doi: 10.1016/j.jcin.2020.12.011. 7. Stefanini GG et al. Coronary stents: novel developments. Heart. 1. Juli 2014; 100(13):1051-61. 8. Low AF. Stent platform for procedural success: Introducing the Continuous Sinusoidal & Core Wire Technologies. Präsentiert auf: AsiaPCR; 22.–24. Januar 2015, Singapur. 9. Tolentino A. Evolving DES Strategy: Biodegradable Polymer vs. Bioabsorbable Scaffold. Präsentiert auf: Cardiovascular Nurse/Technologist Symposium, 17. Juni 2016; New York, USA. 10. Secco G et al. Time-related changes in neointimal tissue coverage of a novel Sirolimus eluting stent: Serial observations with optical coherence tomography. Cardiovascular Revascularization Medicine 17.1 (2016): 38-43. 11. Iglesias JF, et al. Biodegradable polymer sirolimus-eluting stents versus durable polymer everolimus-eluting stents in patients with ST-segment elevation myocardial infarction (BIOSTEMI). The Lancet. 5. Oktober 2019;394(10205):1243-53. 12. Kandzari D et al. Ultrathin Bioresorbable Polymer Sirolimus-Eluting Stents versus Thin Durable Polymer Everolimus-Eluting Stents for Coronary Revascularization: Final 5-year Outcomes from the Randomized BIOFLOW V Trial, Manuskript eingereicht bei JACC, 2022: NCT02389946. 13. BIOTRONIK Daten im Archiv, Stand Februar 2023. 14. Auf Basis der Interpretation präklinischer Studien mit Orsiro durch den Prüfarzt, wie beschrieben in Cassese et al. J Thorac Dis 2018;10(2):688-692. 15. E.Ploumen, BIO-RESORT 5 year outcomes and diabetic subgroup, TCT 2021. 16. Taglieri N et al. Target lesion failure with current drug-eluting stents: Evidence from a comprehensive network meta-analysis. JACC 2020 13(24):2868-78.
Klinische Daten zum Orsiro DES wurden innerhalb des klinischen Programms für die Orsiro-Familie erhoben.
Orsiro, Orsiro Mission, proBIO und BIOlute sind Marken oder eingetragene Marken der Unternehmensgruppe BIOTRONIK. Alle anderen Marken sind Eigentum ihrer jeweiligen Inhaber.