Einschluss des ersten Patienten in die „Leave Nothing Behind“-Studie, mit der Strategie den Einsatz von medikamentbeschichteten Ballons mit medikamentfreisetzenden Stents bei Patienten mit chronischem Totalverschluss zu vergleichen In der randomisierten klinischen Studie soll die Behandlung des chronischen Totalverschlusses untersucht und verbessert werden
BIOTRONIK gab heute den Einschluss des ersten Patienten in die „Leave Nothing Behind“-Studie bekannt. Die Erstimplantation wurde von Dr. Mohamed Ayoub am Herz- und Diabeteszentrum NRW in Deutschland durchgeführt.
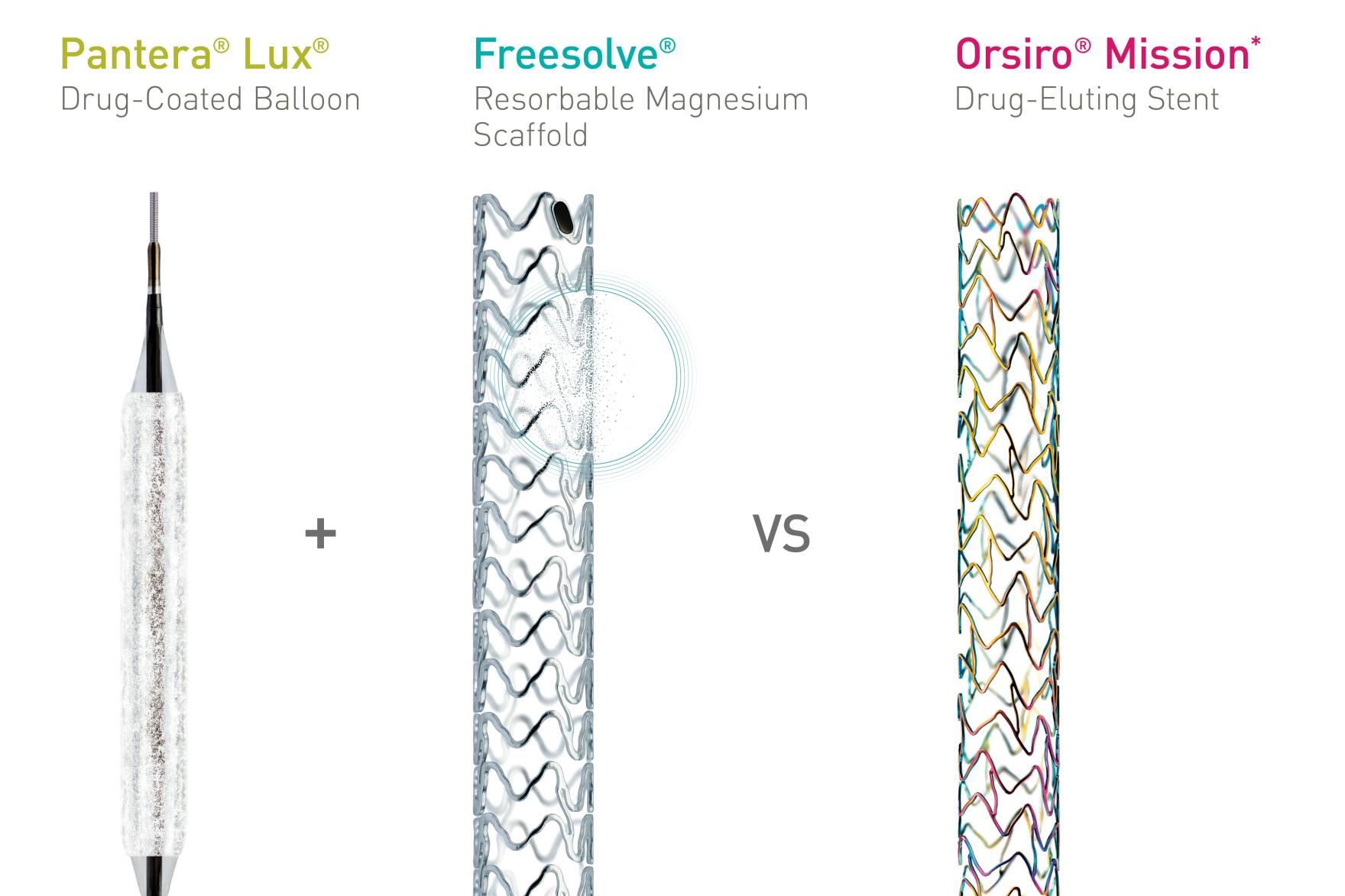
Die Studie soll die Nichtunterlegenheit von medikamentbeschichteten Ballons (DCB) oder DCBs in Kombination mit resorbierbaren Magnesium-Scaffolds (RMS) im Vergleich zu medikamentfreisetzenden Stents (DES) bei perkutanen Koronarinterventionen (PCI) zur Behandlung von chronischen Totalverschlüssen (CTO) belegen. Die prospektive, randomisierte einfach verblindete Studie mit einem Studienzentrum beurteilt die Wirksamkeit des DCB Pantera® Lux® und des RMS Freesolve® im Vergleich zum DES Orsiro® Mission* bei 166 Patientinnen und Patienten mit CTOs.
„Wir möchten untersuchen, ob die Behandlung mit DCBs ─ entweder allein oder mit einem resorbierbaren Magnesium-Scaffold als Notfalloption ─ bei Patientinnen und Patienten mit chronischen Totalverschlüssen medikamentfreisetzenden Stents nicht unterlegen ist“, fasste der leitende Prüfarzt Dr. Mohamed Ayoub von HDZ NRW in Bad Oeynhausen (Deutschland) zusammen. „Wenn die Studie die Nichtunterlegenheit dieses Ansatzes belegt, könnten Patientinnen und Patienten mit CTOs oder komplexen Läsionen routinemäßig mit DCBs oder dem RMS Freesolve behandelt werden, und zwar mit hervorragenden Ergebnissen.“
Die „Leave Nothing Behind“-Studie richtet sich an eine angiographisch klar definierte CTO-Patientengruppe mit J-CTO-Scores zwischen 0 und 3. Die Patientinnen und Patienten werden auf randomisierte Weise im Verhältnis von 1:1 der Behandlung mit DCB/DCB+RMS oder DES zugewiesen. Primärer Endpunkt ist die durchschnittliche Wirksamkeit des Behandlungsansatzes neun Monate nach der Implantation. Klinische Endpunkte, einschließlich schwerwiegender unerwünschter kardialer Ereignisse, bei den Nachuntersuchungen nach neun Monaten und drei Jahren bilden den sekundären Endpunkt.
„Wir freuen uns sehr über den Start dieser Studie, die einen bedeutenden Schritt vorwärts auf dem Weg zu besseren Behandlungsergebnissen und einer höheren Lebensqualität der Patientinnen und Patienten darstellt“, sagte Prof. Dr. Georg Nollert, Vice President Medical Affairs, Vascular Intervention bei BIOTRONIK. „Während chronische Totalverschlüsse immer häufiger auftreten, könnte der Einsatz fortschrittlicher Technologien wie des DCB Pantera Lux und des RMS Freesolve den Weg für neue Standards in der CTO-Behandlung ebnen, da sie im Körper nichts zurücklassen und zukünftige Eingriffe einfacher durchgeführt werden können.“
-ENDE-
Referenzen:
* Die klinischen Daten wurden mit dem medikamentfreisetzenden Stent Synsiro® Pro erhoben. Der DES Synsiro® Pro gehört zur DES-Familie Orsiro® und eignet sich zum Beleg der klinischen Sicherheit und Wirksamkeit des DES Orsiro® Mission.
Weitere Informationen finden Sie unter: BIOTRONIK What would you choose?
Der RMS Freesolve® ist in Ländern erhältlich, die das CE-Zeichen akzeptieren.
Pantera, Lux, Freesolve, Orsiro, Orsiro Mission und Synsiro sind Marken oder eingetragene Marken der Unternehmensgruppe BIOTRONIK.
Über BIOTRONIK:
Bei BIOTRONIK steht das Wohlbefinden der Patientinnen und Patienten an erster Stelle – und das seit mehr als 60 Jahren. BIOTRONIK ist ein weltweit führendes Medizintechnikunternehmen. Unsere Produkte und Dienstleistungen retten und verbessern das Leben von Millionen von Menschen mit Herz- und Gefäßerkrankungen sowie chronischen Schmerzen. Mit dem Ziel, Technologie perfekt den individuellen Patientenbedürfnissen anzupassen, verstehen wir uns als Innovatoren und entwickeln zuverlässige kardiovaskuläre, endovaskuläre und neuromodulatorische Lösungen. BIOTRONIK hat seinen Hauptsitz in Berlin und ist in über 100 Ländern in den Regionen Amerika, EMEA (Europa, Naher Osten und Afrika) sowie Asien-Pazifik vertreten.